Siden dette tallet bare er irriterende komplisert er det innført en egen enhet for atommasse: u (unified mass unit). Protonet og nøytronet har hver en masse på omtrent 1 u, og elektronets masse er omtrent 0,5 % av det igjen. For å holde styr på alt dette her har forskerne innført begrepene protontall, nøytrontall og nukleontall. Protontall og nøytrontall er selvforklarende, og nukleontall er tallet på nøytroner og protoner til sammen i atomets kjerne. 

Ett grunnstoff (i eksempelet karbon) kan ha fvarierende antall nøytroner, og da forskjellig nukleontall og forskjellig masse, og disse variasjonene kalles isotoper. Noen isotoper finnes oftere i naturen enn andre, og det er gjennomsnittsmassen av alle isotopene vi finner i periodesystemet under atommasse. Visse isotoper har ustabile kjerner, og blir da radioaktive (kreftfremkallende greier, not pretty).
Elektronfordelingen til et atom forteller oss hvordan elektronene er ordnet rundt kjernen. Som med solen og planetene ferdes noen elektroner nærmere rundt kjernen enn andre (ulikt planetene finnes det ikke liv i den tredje banen. Tror vi. Det hadde vært disturbing).

I elektronskymodellen (ovenfor) tenker vi at atomkjernen er omgitt av en eller fler elektronskyer i bestemte avstander fra kjernen. Prikkene i skyen står ikke for ett elektron, men for sannsynligheten for at vi finner et elektron der (Prøv å ikke tenk for mye på det). I et nøytralt litiumatom, slik det på bildet over, er det bare tre elektroner, og to av elektronene finner vi i den innerste ringen av sky helt inne ved kjernen, og det siste i den store skyringen utenfor. denne elektronfordelingen (hvis du skal være proff: elektronkonfigurasjonen) bestemmer grunnstoffets kjemiske egenskaper. 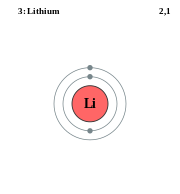

Over er det et bilde av Litiumatomet når vi bruker skallmodellen. De grå prikkene er elektronene. Elektroner i forskjellige skall har forskjellig energi. Jo nærmere ett elektron er kjernen, jo større tiltrekningskraft er det mellom de to (love is in the air), og hvis et elektron som ligger i det innerste skallet vil ut til det utenfor, må vi tilføre energi (breaking up is hard to do). Dermed får elektronene mer og mer energi jo lenger de kommer fra kjernen. Det innerste skallet kalles for K-skallet, og det fortsetter utover med L-skallet, M-, N- osv.
I K-skallet finner vi to elektroner som begge har like stor energi (mormoner-forhold?), i L-skallet er det derimot to ulike energinivåer, i M- tre energinivåer osv. Det laveste energinivået i et skall har to elektroner (vanskelig å ha like nære forhold til mer enn to personer samtidig altså, ta lærdom). Det nest laveste kan inneholde 6 elektroner, det over der igjen 10, over der 14 osv. Elektronskyene på de ulike energinivåene har også ulik form.
Uansett. Elektronene i K skallet har lavere energi enn elektronene i L-skallet, og L-skallet har lavere energi enn M-skallet. I M-skallet blir ting litt mer komplisert. M-skallets 3. energinivå ligger så høyt at det ikke fylles før det laveste energinivået i N-skallet er fylt. Så grunnstoffet Kalsium vil altså få to elektroner i K-skallet, 8 i L-skallet, 8 i M-skallet og 2 i N-skallet. Elektronene i det ytterste skallet kalles for valenselektroner.


Ingen kommentarer:
Legg inn en kommentar